1. Електроліти.
2. Дисоціація.
3. Електричний струм в електролітах.
4. Закони електролізу (закони Фарадея).
5. Хімічний еквівалент речовини.
6. Застосування електролізу.
ДОМАШНЄ ЗАВДАННЯ
1. Підручник (К): опрацювати §21(3).
2. №№75,69,58
1. Матеріали до уроку >>>
2. Електричний струм у рідинах
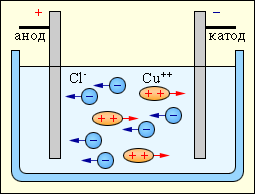
Електроліти – це речовини, електричний струм у яких завжди супроводжується їх хімічними змінами. Це розчини солей, кислот і лугів у воді. У таких розчинах постійно відбувається розпад молекул на іони. Цей процес називається електролітичною дисоціацією. Внаслідок дисоціації в розчині утворюються позитивні (катіони) іони металів і водню, та негативні (аніони) іони кислотних залишків і гідроксильної групи. У стані динамічної рівноваги розчин характеризується ступенем дисоціації – відношенням числа n молекул, які дисоціювали на іони, до загального числа n0 молекул речовини:
При підвищенні температури питомий опір електроліту зменшується, а питома провідність збільшується.
Проходження електричного струму через електроліт супроводжується явищем електролізу – виділення на електродах речовин, що входять до складу електроліту. Англійський фізик М. Фарадей в 1833 р установив закони електролізу.
Перший закон електролізу: маса m речовини, яка виділяється на електроді, пропорційна електричному заряду Q, що пройшов через електроліт:
( І=Q/t – сила пропорційного струму, що проходить через розчин за час t).
k – електрохімічний еквівалент речовини, який дорівнює масі речовини, що виділилася на електроді під час проходження через електроліт заряду в 1 Кл.
Другий закон електролізу: електрохімічний еквівалент речовини пропорційний їх хімічному еквіваленту: 
де М – молярна маса, F – стала Фарадея,
F = 9,65·107 Кл/кг ? 96500 Кл/моль.
Електроліз використовують для добування чистих металів, покриття металевим шаром виробів з металів (гальваностегія), електролітичного полірування (гальванопластика).
Немає коментарів:
Дописати коментар